O 5 de xullo, Novo Nordisk lanzou un ensaio clínico de fase III da inxección de CagriSema en China, cuxo propósito é comparar a seguridade e eficacia da inxección de CagriSema coa semeglutida en pacientes obesos e con sobrepeso en China.
A inxección de CagriSema é unha terapia combinada de acción prolongada que está a desenvolver Novo Nordisk, os compoñentes principais son a esmeglutida agonista do receptor GLP-1 (péptido similar ao glucagón-1) e unha cagrilintida análoga de amilina de acción prolongada.A inxección de CagriSema pódese administrar por vía subcutánea unha vez por semana.
O obxectivo principal foi comparar CagriSema (2,4 mg/2,4 mg) con semeglutida ou placebo unha vez por semana por vía subcutánea.Novo Nordisk anunciou os resultados dun ensaio de CagriSema para o tratamento da diabetes en fase 2, que demostrou que o efecto hipoglucémico de CagriSema é mellor que o da semeglutida, e case o 90% dos suxeitos acadaron o obxectivo de HbA1c.
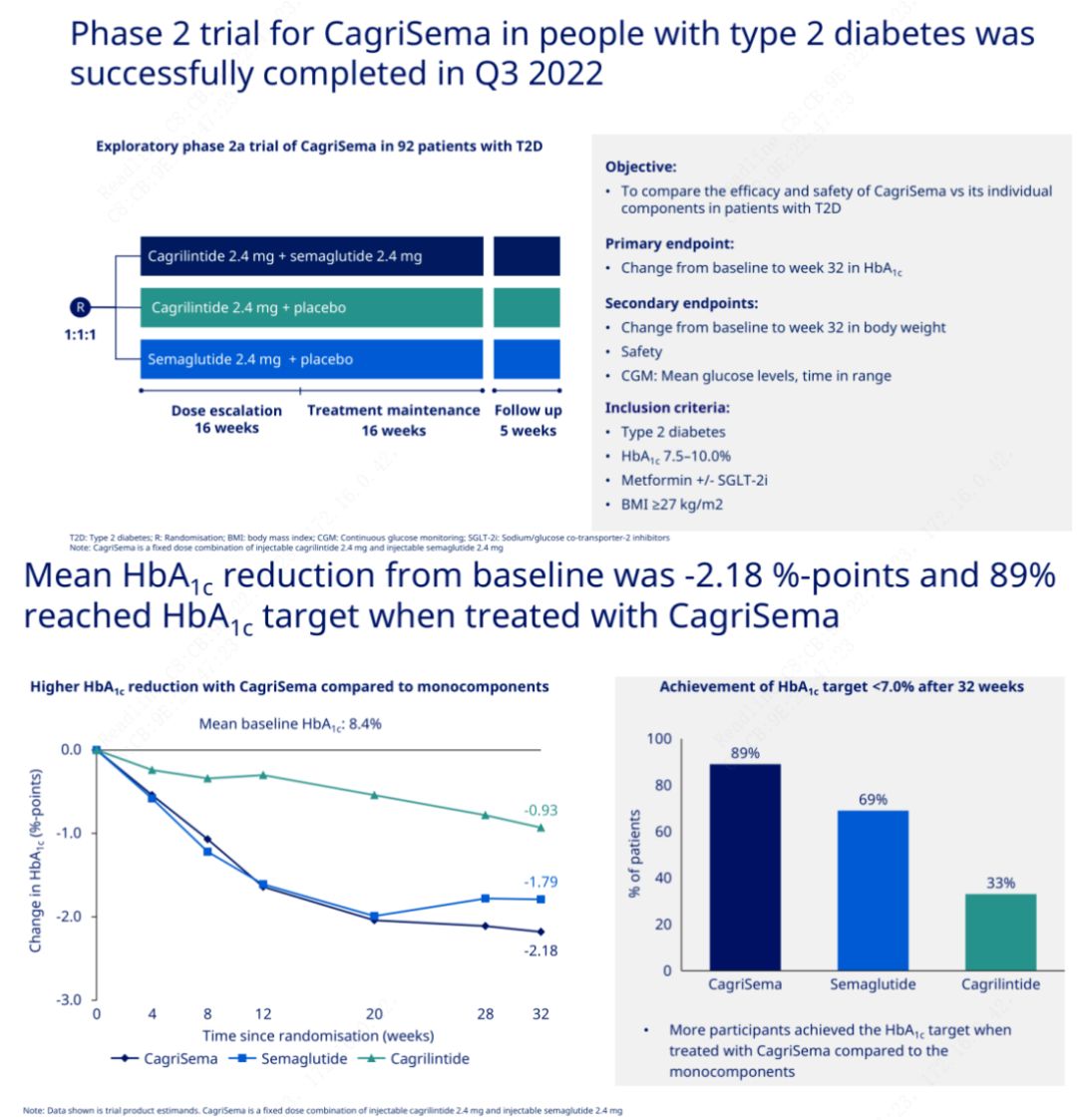
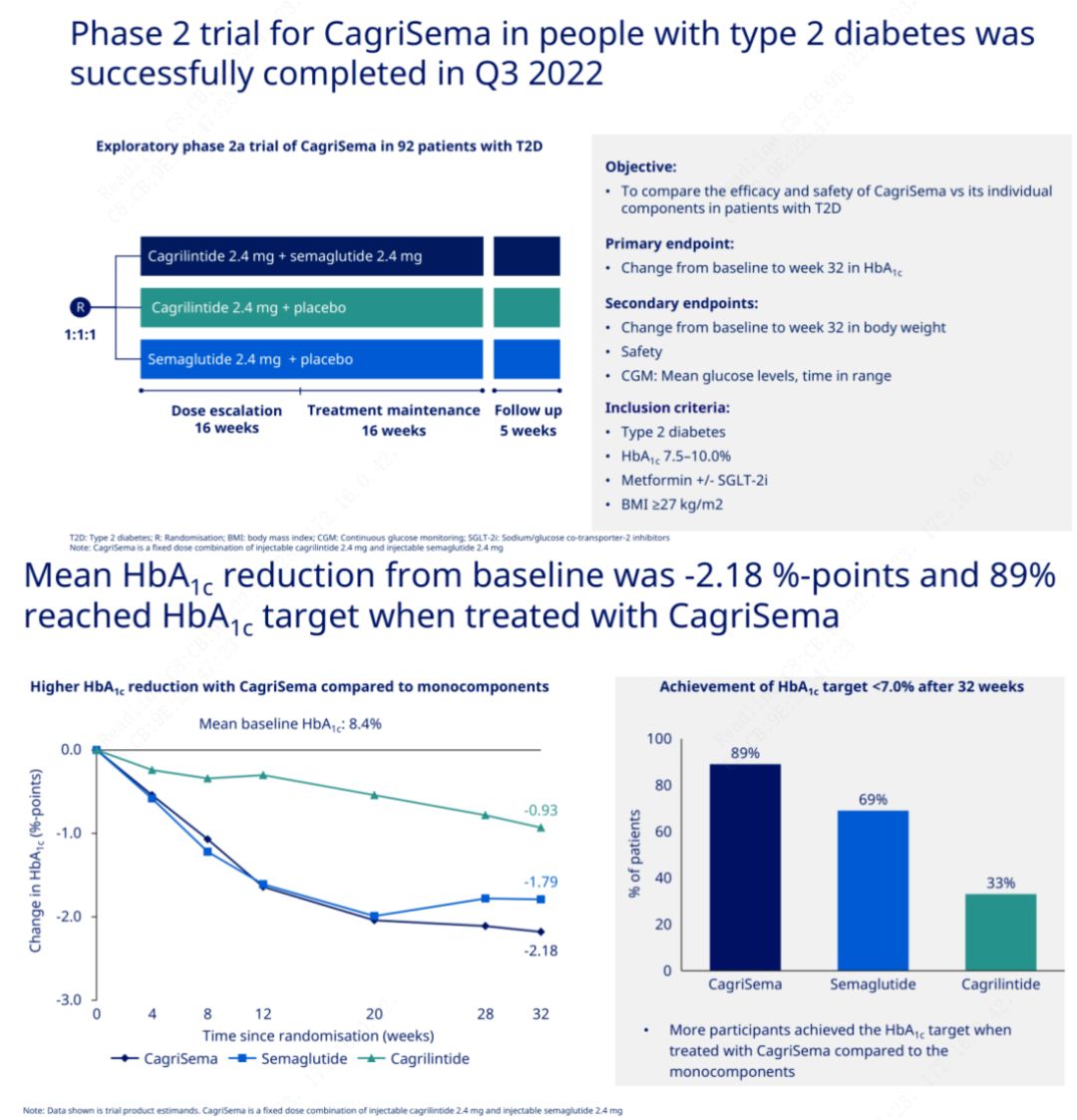
Os datos mostraron que, ademais do importante efecto hipoglucémico, en termos de perda de peso, a inxección de CagriSema superou significativamente á semeglutida (5,1%) e á cagrilintida (8,1%) cunha perda de peso do 15,6%.
O fármaco innovador Tirzepatide é o primeiro agonista do receptor GIP/GLP-1 semanal aprobado do mundo.Combina os efectos de dúas incretinas nunha única molécula que se inxecta unha vez por semana e é unha nova clase de tratamentos para a diabetes tipo 2.A tirzepatida foi aprobada pola Food and Drug Administration (FDA) dos Estados Unidos en maio de 2022 para mellorar o control glicémico (sobre unha base dietética e exercicio físico) en adultos con diabetes tipo 2 e actualmente está aprobada na Unión Europea, Xapón e outros países.
O 5 de xullo, Eli Lilly anunciou un estudo de fase III SURPASS-CN-MONO sobre a plataforma de rexistro de ensaios clínicos de medicamentos e divulgación de información para o tratamento de pacientes con diabetes tipo 2.SURPASS-CN-MONO é un estudo de fase III aleatorizado, dobre cego e controlado con placebo deseñado para avaliar a eficacia e a seguridade da monoterapia con tirzepatida en comparación co placebo en persoas con diabetes tipo 2.O estudo planeaba incluír a 200 pacientes con diabetes tipo 2 que non tomaban ningún medicamento antidiabético nos 90 días anteriores á visita 1 (excepto en determinadas situacións clínicas, como enfermidade aguda, hospitalización ou cirurxía electiva, a curto prazo (≤14). días) uso de insulina).
Espérase que a diabetes tipo 2 sexa aprobada este ano
O mes pasado, os resultados dun estudo SURPASS-AP-Combo publicáronse o 25 de maio na exitosa revista Nature Medicine.Os resultados mostraron que, en comparación coa insulina glargina, Tirzepatide mostrou unha mellor HbA1c e unha redución de peso na poboación de pacientes con diabetes tipo 2 na rexión de Asia-Pacífico (principalmente China): redución de HbA1c de ata un 2,49% e redución de peso de ata 7,2 kg. (9,4%) ás 40 semanas de tratamento, a mellora significativa dos lípidos no sangue e a presión arterial, e a seguridade e tolerabilidade en xeral foron boas.
O ensaio clínico de fase 3 de SURPASS-AP-Combo é o primeiro estudo de Tirzepatide realizado principalmente en pacientes chineses con diabetes tipo 2, dirixido polo profesor Ji Linong do Hospital Popular da Universidade de Pequín.SURPASS-AP-Combo é consistente cos resultados da serie global de investigación SURPASS, que demostra ademais que a fisiopatoloxía da diabetes en pacientes chineses é consistente coa dos pacientes mundiais, que é a base para a investigación e o desenvolvemento simultáneos de novos fármacos. en China e no mundo, e tamén ofrece un apoio sólido para ofrecer aos pacientes chineses a oportunidade de usar os últimos medicamentos para o tratamento da diabetes e a súa aplicación clínica en China o antes posible.
Hora de publicación: 18-09-2023

