A proteína beta-amiloide humana (1-42), tamén coñecida como Aβ 1-42, é un factor clave para desvelar os misterios da enfermidade de Alzheimer.Este péptido xoga un papel central na formación de placas amiloides, enigmáticos cúmulos que danan o cerebro dos enfermos de Alzheimer.Cun efecto destrutivo, interrompe a comunicación neuronal, desencadea a inflamación e induce neurotoxicidade, o que provoca deterioro cognitivo e dano neuronal.Investigar os seus mecanismos de agregación e toxicidade non só é vital;é unha viaxe emocionante para resolver o enigma do Alzheimer e desenvolver futuras terapias.



Aβ 1-42 é un fragmento peptídico de 42 aminoácidos que se deriva da escisión da proteína precursora do amiloide (APP) por β- e γ-secretases.Aβ 1-42 é un dos principais compoñentes das placas amiloides que se acumulan no cerebro dos pacientes con enfermidade de Alzheimer, un trastorno neurodexenerativo caracterizado por deterioro cognitivo e perda de memoria.Demostrouse que Aβ 1-42 ten varias funcións e aplicacións na investigación biolóxica e biomédica, como:
1. Neurotoxicidade: Aβ 1-42 pode formar oligómeros solubles que son capaces de unirse ás membranas neuronais, receptores e sinapses e perturbar a súa función.Estes oligómeros tamén poden inducir estrés oxidativo, inflamación e apoptose nas neuronas, o que leva á perda sináptica e á morte neuronal.Os oligómeros Aβ 1-42 considéranse máis neurotóxicos que outras formas de Aβ, como o Aβ 1-40, que é a forma máis abundante de Aβ no cerebro.Tamén se cre que os oligómeros Aβ 1-42 poden propagarse de célula a célula, de forma similar aos prións, e desencadean o mal pregamento e a agregación doutras proteínas, como a tau, que forma enredos neurofibrilares na enfermidade de Alzheimer.
Aβ 1-42 considérase amplamente como a isoforma Aβ con maior neurotoxicidade.Varios estudos experimentais demostraron a neurotoxicidade de Aβ 1-42 utilizando diferentes métodos e modelos.Por exemplo, Lesné et al.(Brain, 2013) investigou a formación e toxicidade dos oligómeros Aβ, que son agregados solubles de monómeros Aβ, e demostraron que os oligómeros Aβ 1-42 tiñan un efecto prexudicial máis forte nas sinapses neuronais, o que provocou un deterioro cognitivo e unha perda neuronal.Lambert et al.(Proceedings of the National Academy of Sciences, 1998) destacaron a neurotoxicidade dos oligómeros Aβ 1-42 e descubriron que tiñan un forte efecto tóxico sobre o sistema nervioso central, posiblemente ao afectar as sinapses e os neurotransmisores.Walsh et al.(Nature, 2002) mostrou o efecto inhibidor dos oligómeros Aβ 1-42 sobre a potenciación a longo prazo do hipocampo (LTP) in vivo, que é un mecanismo celular subxacente á aprendizaxe e á memoria.Esta inhibición estivo asociada co deterioro da memoria e da aprendizaxe, facendo fincapé no impacto dos oligómeros Aβ 1-42 na plasticidade sináptica.Shankar et al.(Nature Medicine, 2008) illou os dímeros Aβ 1-42 directamente dos cerebros de Alzheimer e mostraron o seu efecto sobre a plasticidade sináptica e a memoria, proporcionando evidencia empírica da neurotoxicidade dos oligómeros Aβ 1-42.
Ademais, Su et al.(Molecular & Cellular Toxicology, 2019) realizou análises de transcriptómica e proteómica da neurotoxicidade inducida por Aβ 1-42 en células de neuroblastoma SH-SY5Y.Identificaron varios xenes e proteínas que se viron afectados por Aβ 1-42 en vías relacionadas co proceso apoptótico, a tradución de proteínas, o proceso catabólico do cAMP e a resposta ao estrés do retículo endoplasmático.Takeda et al.(Biological Trace Element Research, 2020) investigou o papel do Zn2+ extracelular na neurotoxicidade inducida por Aβ 1-42 na enfermidade de Alzheimer.Mostraron que a toxicidade intracelular de Zn2+ inducida por Aβ 1-42 acelerábase co envellecemento debido ao aumento do Zn2+ extracelular relacionado coa idade.Suxeriron que o Aβ 1-42 secretado continuamente polos terminais neuronais causa un declive cognitivo e neurodexeneración relacionados coa idade mediante a desregulación intracelular de Zn2+.Estes estudos suxiren que Aβ 1-42 é un factor clave na mediación da neurotoxicidade e da progresión da enfermidade na enfermidade de Alzheimer ao afectar a varios procesos moleculares e celulares do cerebro.
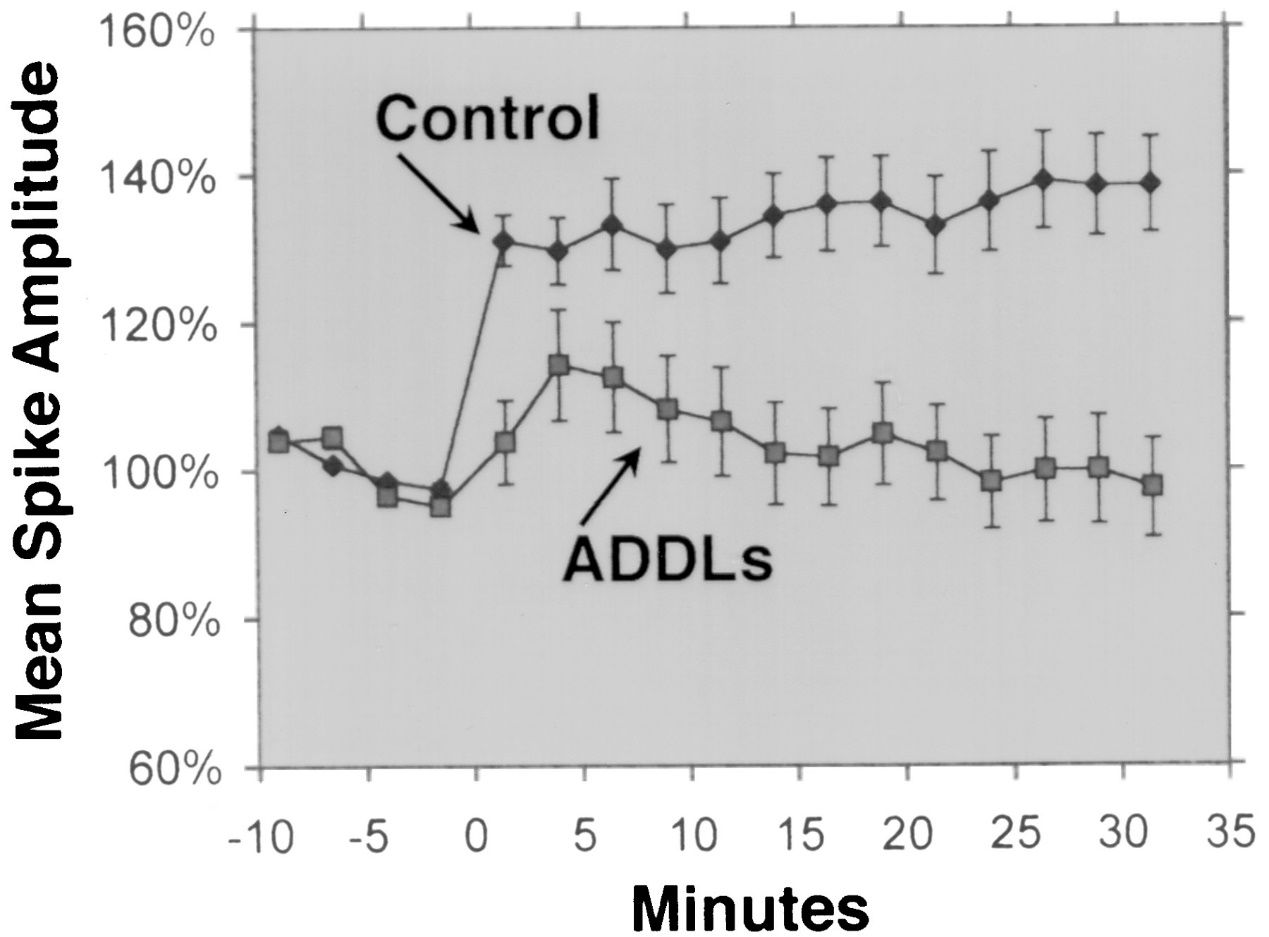
2. Actividade antimicrobiana: Aβ 1-42 ten actividade antimicrobiana contra varios patóxenos, como bacterias, fungos e virus.Aβ 1-42 pode unirse e romper as membranas das células microbianas, provocando a súa lise e morte.Aβ 1-42 tamén pode activar o sistema inmunitario innato e recrutar células inflamatorias no lugar da infección.Algúns estudos suxeriron que a acumulación de Aβ no cerebro pode ser unha resposta protectora a infeccións ou lesións crónicas.Non obstante, a produción excesiva ou desregulada de Aβ tamén pode causar danos colaterales ás células e tecidos hóspedes.
Aβ 1-42 exhibe actividade antimicrobiana contra unha serie de patóxenos, como bacterias, fungos e virus, como Staphylococcus aureus, Escherichia coli, Candida albicans e virus do herpes simplex tipo 1, ao interactuar coas súas membranas e provocando a súa interrupción e lise.Kumar et al.(Journal of Alzheimer's Disease, 2016) demostrou este efecto mostrando que Aβ 1-42 alteraba a permeabilidade da membrana e a morfoloxía das células microbianas, levando á súa morte.Ademais da súa acción antimicrobiana directa, Aβ 1-42 tamén pode modular a resposta inmune innata e recrutar células inflamatorias no lugar da infección.Soscia et al.(PLoS One, 2010) revelou este papel ao informar de que Aβ 1-42 estimulou a produción de citocinas e quimiocinas proinflamatorias, como a interleucina-6 (IL-6), o factor de necrose tumoral alfa (TNF-α), o monocito. a proteína quimioatrayente-1 (MCP-1) e a proteína inflamatoria de macrófagos-1 alfa (MIP-1α), na microglia e os astrocitos, as principais células inmunitarias do cerebro.
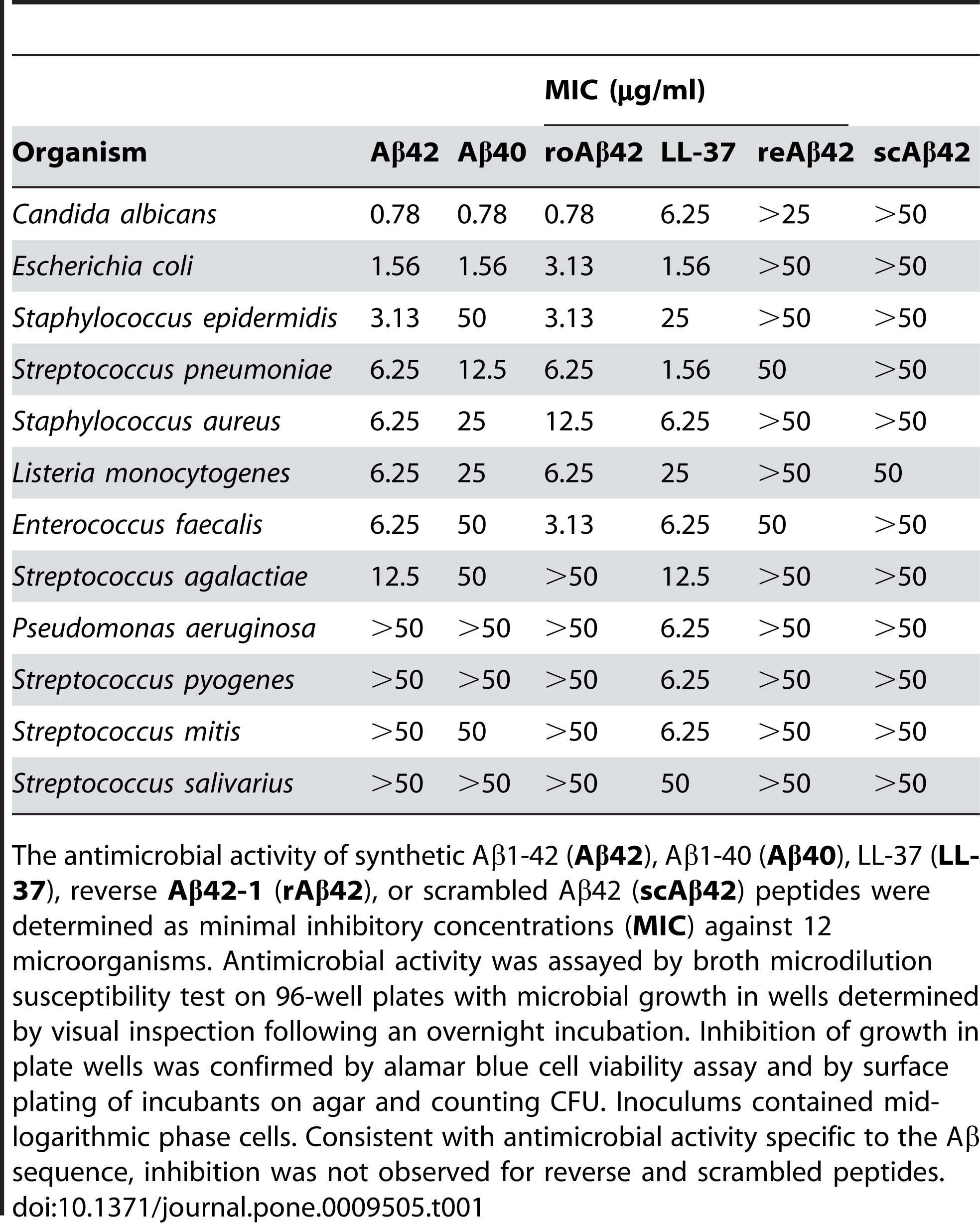
Figura 2. Os péptidos Aβ posúen actividade antimicrobiana.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. A proteína beta amiloide asociada á enfermidade de Alzheimer é un péptido antimicrobiano. PLoS One 3 de marzo de 2010; 5(3):e9505.)
Aínda que algúns estudos suxeriron que a acumulación de Aβ no cerebro pode ser unha resposta protectora a infeccións ou lesións crónicas, xa que Aβ pode actuar como un péptido antimicrobiano (AMP) e eliminar potenciais patóxenos, a complexa interacción entre Aβ e os elementos microbianos segue sendo un problema. tema de investigación.O delicado equilibrio é destacado pola investigación de Moir et al.(Journal of Alzheimer's Disease, 2018), que suxire que a produción desequilibrada ou excesiva de Aβ pode danar inadvertidamente ás células e tecidos hóspedes, o que reflicte a complexa natureza dobre dos papeis de Aβ na infección e na neurodexeneración.A produción excesiva ou desregulada de Aβ pode levar á súa agregación e deposición no cerebro, formando oligómeros tóxicos e fibrillas que prexudican a función neuronal e inducen neuroinflamación.Estes procesos patolóxicos están asociados ao deterioro cognitivo e á perda de memoria na enfermidade de Alzheimer, un trastorno neurodexenerativo caracterizado por unha demencia progresiva.Polo tanto, o equilibrio entre os efectos beneficiosos e prexudiciais da Aβ é crucial para manter a saúde cerebral e previr a neurodexeneración.
3. Exportación de ferro: Demostrouse que o Aβ 1-42 está implicado na regulación da homeostase do ferro no cerebro.O ferro é un elemento esencial para moitos procesos biolóxicos, pero o exceso de ferro tamén pode provocar estrés oxidativo e neurodexeneración.Aβ 1-42 pode unirse ao ferro e facilitar a súa exportación das neuronas a través da ferroportina, un transportador transmembrana de ferro.Isto pode axudar a previr a acumulación de ferro e a toxicidade no cerebro, xa que o exceso de ferro pode causar estrés oxidativo e neurodexeneración.Duce et al.(Cell, 2010) informou de que Aβ 1-42 uniuse á ferroportina e aumentou a súa expresión e actividade nas neuronas, o que leva a reducións dos niveis intracelulares de ferro.Tamén demostraron que Aβ 1-42 reduciu a expresión da hepcidina, unha hormona que inhibe a ferroportina, nos astrocitos, mellorando aínda máis a exportación de ferro das neuronas.Non obstante, o Aβ unido ao ferro tamén pode facerse máis propenso á agregación e á deposición no espazo extracelular, formando placas amiloides.Ayton et al.(Journal of Biological Chemistry, 2015) informou de que o ferro promoveu a formación de oligómeros e fibrillas Aβ in vitro e in vivo.Tamén demostraron que a quelación de ferro reduciu a agregación e a deposición de Aβ en ratos transxénicos.Polo tanto, o equilibrio entre os efectos beneficiosos e prexudiciais de Aβ 1-42 na homeostase do ferro é crucial para manter a saúde cerebral e previr a neurodexeneración.
Somos un fabricante de polipéptidos en China, con varios anos de experiencia na produción de polipéptidos.Hangzhou Taijia Biotech Co., Ltd. é un fabricante profesional de materias primas polipeptídicas, que pode proporcionar decenas de miles de materias primas polipeptídicas e tamén se pode personalizar segundo as necesidades.A calidade dos produtos polipeptídicos é excelente e a pureza pode alcanzar o 98%, o que foi recoñecido por usuarios de todo o mundo. Benvido a consultarnos.






